Viren verändern sich fortlaufend. Grundlage für diese Veränderungen sind zufällig auftretende Mutationen. Dem Coronavirus SARS-CoV-2 ermöglichten durch Mutationen entstandene Veränderungen den Menschen zu infizieren. Mittlerweile stellen neue Mutationen in SARS-CoV-2 erste Errungenschaften gegen das Virus, wie beispielsweise entwickelte Impfstoffe, wieder auf die Probe. Es ist ein Wettlauf zwischen Virus und Mensch. Ein Anlass für die Zoonosenplattform, sich im Gespräch mit der Virusforscherin Dr. Imke Steffen einmal mit dem Thema Mutationen zu beschäftigen.
Dr. Imke Steffen ist Mitglied des Internen Beirats der Zoonosenplattform und leitet eine Nachwuchsforschungsgruppe an der TiHo Hannover, die sich unter anderem mit emerging RNA-Viren und deren Interaktion mit menschlichen und tierischen Wirten beschäftigt. Mit ihr sprach die Zoonosenplattform unter anderem über die Fragen was Mutationen sind, wie sie entstehen und welche Rolle die Umwelt spielt.
„Mutationen sind Veränderungen der genetischen Sequenz“
ZOOP: Frau Steffen, vielen Dank zunächst einmal, dass Sie sich die Zeit nehmen, unsere Fragen zu beantworten. Steigen wir doch einfach einmal in das Thema Mutationen ein mit der Frage: „Was ist eine Mutation?“
Steffen: Mutationen sind Veränderungen der genetischen Sequenz. Hierbei unterscheiden man zwischen verschiedenen Arten von Mutationen. Zum einen gibt es Punktmutationen, bei denen einzelne Basen der Sequenz ausgetauscht werden. Dann gibt es andere Formen, bei denen größere Bereiche verändert werden. Allgemein gesprochen ist eine Mutation aber eine Veränderung der genetischen Information.
ZOOP: Wie kommt es zu Mutationen? Wie können diese entstehen?
Steffen: Das passiert im Allgemeinen, wenn die Erbinformation von Viren, oder auch von höheren Lebewesen, im Zuge der Vermehrung kopiert wird. Bei diesen Kopiervorgängen kann es zu Fehlern kommen, da die an dem Prozess beteiligten Enzyme nicht fehlerfrei arbeiten. Dadurch können Veränderungen ins Genom eingefügt werden, so dass sich die kopierte von der Ausgangssequenz unterscheidet.
ZOOP: Sind das immer nur einzelne kleine Veränderungen oder können diese auch größer sein?
Steffen: Das hängt davon ab, welche Art der Mutation vorliegt. Bei Punktmutationen werden einzelne Basen falsch eingesetzt und führen zu Veränderungen, die sich im Genom verfestigen können. Bei sogenannten Rekombinationen werden gesamte Bereiche des Genoms ausgetauscht. Dies kann dadurch zustande kommen, dass das Enzym, welches für den Kopiervorgang zuständig ist, die Vorlage für die Kopie innerhalb des Vorganges wechselt. Das kann passieren, wenn innerhalb einer Zelle mehrere Kopien eines Virus vorliegen und das Enzym zwei dieser Kopien als Vorlage miteinander kombiniert. Bei so einer Rekombination können ganze Regionen des Genoms verändert werden.
ZOOP: Um Mutationen zu finden gibt es die Möglichkeit, eine Sequenzierung durchzuführen, also sich die komplette Basenabfolge eines Genoms anzuschauen und auf Veränderungen hin zu untersuchen. Eine andere Möglichkeit bieten PCRs (Polymerase Chain Reactions), mit denen Teile eines Genoms vervielfältigt werden können. Wie genau funktioniert das?
Steffen: Bei der Sequenzierung hat man in den letzten Jahren große Fortschritte gemacht, so dass man mittlerweile aus verschiedenen Sequenzen verschieden Genomvarianten ausmachen kann. Dennoch ist eine Sequenzierung nach wie vor mit relativ großem Aufwand verbunden. In der Diagnostik verwendet man daher eher die PCR, die es einem erlaubt, Fragmente eines Genoms gezielt zu vermehren und anzureichern, so dass man dann gezielt Abschnitte sequenziert und bestimmte Mutationen so nachweisen kann. Man kann auch die PCR selber so designen, dass bestimmte Varianten erkannt werden können und andere nicht. Man spricht in diesem Fall von einer Typ-spezifischen PCR. Hierfür designt man die so genannten Primer (kurze Abschnitte, die an bestimmte Sequenzabschnitte binden) so, dass sie nur an die Sequenzen bestimmter Varianten binden können. Auf diesem Weg kann man zwischen verschiedenen Varianten unterscheiden. Voraussetzung hierfür ist natürlich, dass man die gesuchten Mutationen kennt. Die Methode eignen sich nicht um unbekannte neue Mutationen zu finden, sondern man muss die Unterschiede auf Sequenzbasis kennen.
„Das Genom von RNA-Viren verändert sich etwa 1 Millionen Mal schneller als das menschliche“
ZOOP: Die Mutationsrate bei RNA-Viren, also die Rate mit der Veränderungen im Genom auftreten, unterscheidet sich von der Mutationsrate menschlicher Zellen. Woran liegt das?
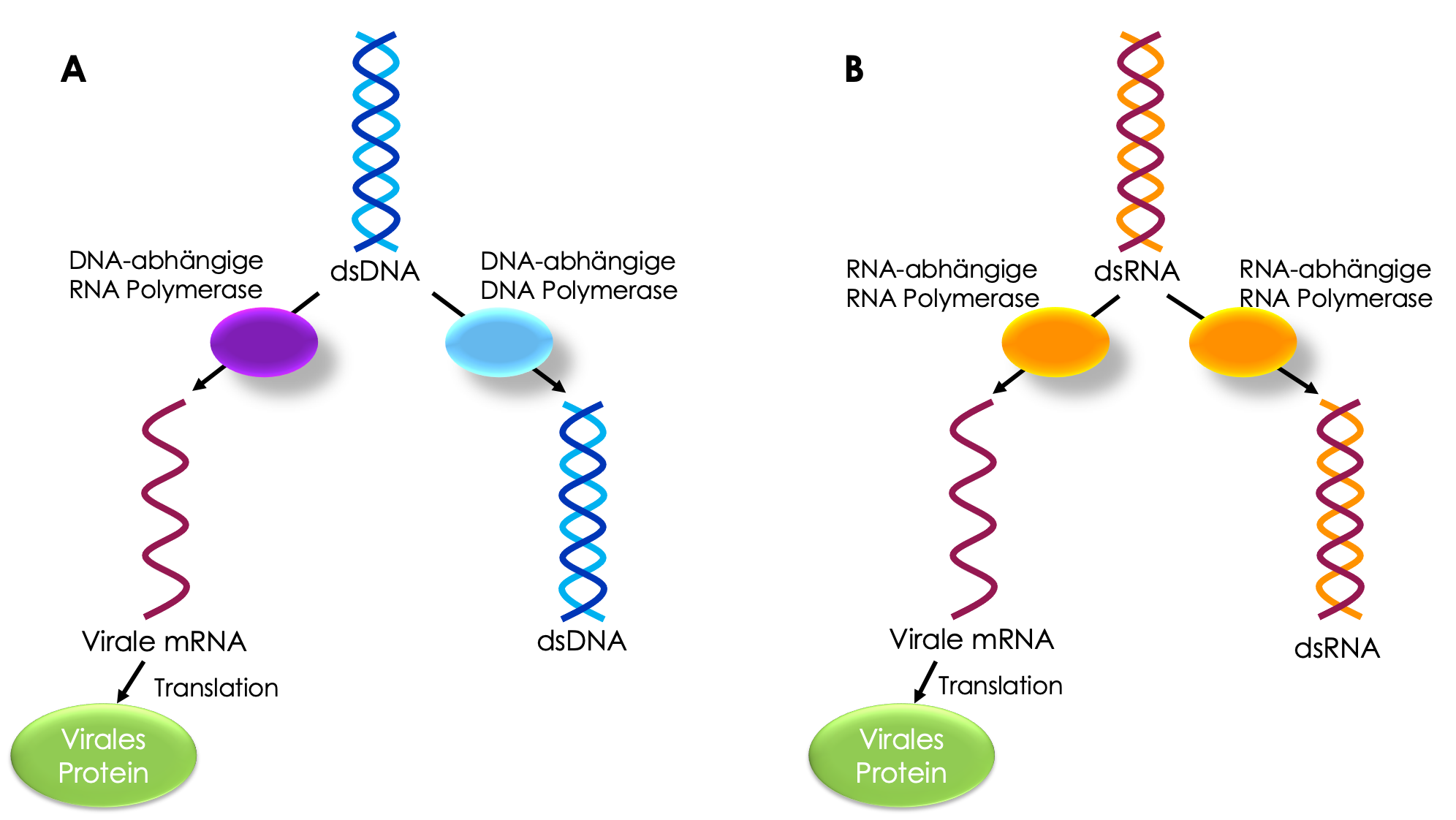
Steffen: Tatsächlich geht man davon aus, dass sich das Genom von RNA-Viren etwa 1 Millionen Mal schneller verändert als das menschliche. Das liegt zum einen daran, dass sich RNA nicht so gut kopieren lässt. Das menschliche Genom besteht aus DNA, welche im Vergleich zu RNA sehr viel stabiler ist. Zudem arbeiten die Enzyme, welche die DNA vermehren, die sogenannten DNA-Polymerasen genauer als RNA-Polymerasen. Die Viren kodieren meist für ihre eigenen RNA abhängige RNA-Polymerase, da diese in den Wirtszellen nicht vorliegt. In menschlichen Zellen wird RNA auf Grundlage von DNA hergestellt. Der Vorgang RNA anhand einer RNA-Vorlage zu erstellen ist ein besonderes Merkmal der RNA-Viren. Allerdings haben diese RNA-Polymerasen im Gegensatz zu DNA-Polymerasen keine eigene proof-reading (Korrektur) Funktion, welche entstandene Fehler in der neu kopierten Sequenz ggf. korrigieren kann. Dadurch entstehen bei dem Kopiervorgang von RNA zu RNA mehr Fehler als bei der Kopie von DNA-Molekülen.
Replikation und Translation von doppelsträngigen (ds) RNA- und DNA-Viren A) Viren, deren Genom als dsDNA vorliegt, benötigen für die Kopie der Erbinformationen eine DNA-abhängige DNA-Polymerase. Die Translation der Erbinformationen in ein Protein erfolgt über eine DNA-abhängige RNA Polymerase hin zu einer Messenger RNA (mRNA). B) Bei RNA-Viren liegt das Genom als RNA vor. Zur Replikation und Translation werden daher andere Enzyme benötigt. Alternativ kann die Erbinformation bei Viren auch als einzelsträngiges DNA oder RNA-Molekül vorliegen. Die Fehlerrate beim Vervielfältigungsprozess unterscheidet sich zwischen den verschiedenen Genomtypen.
ZOOP: Hat es Auswirkungen auf die Mutationsrate, ob die DNA oder RNA als Einzel- oder Doppelstrang vorliegt?
Steffen: Sowohl DNA- als auch RNA-Viren können doppelsträngige oder einzelsträngige Genome besitzen. Tatsächlich scheint es, dass doppelsträngige Genome einen gewissen Schutz gegenüber Mutationen bieten im Vergleich mit den einzelsträngigen. Auch die Struktur der Genome spielt also eine Rolle.
„Coronaviren haben im Vergleich mit anderen RNA-Viren eher eine niedrigere Mutationsrate“
ZOOP: Wie stellt sich die Mutationsrate von Coronaviren im Vergleich mit anderen RNA-Viren dar?
Steffen: Die Coronaviren stellen tatsächlich innerhalb der RNA-Viren noch einmal eine Besonderheit dar, da sie im Vergleich mit anderen RNA-Viren das längste Genom besitzen. Normalerweise begrenzt die Mutationsrate die Größe des Genoms, da mit zunehmender Genomgröße natürlich auch die Anzahl an Fehlern pro Kopiervorgang steigen kann. Die Coronaviren können sich ein so großes Genom nur leisten, weil sie für ein zusätzliches Enzym kodieren, welches die vorher angesprochene Korrekturfunktion übernimmt. Aus diesem Grund haben Coronaviren im Vergleich mit anderen RNA-Viren eher eine niedrigere Mutationsrate.
„Man muss sich klar machen, dass Mutationen zufällig, zunächst als Einzelfall geschehen“
ZOOP: Wenn man in Betracht zieht, dass einige Mutationen auch negative Auswirkungen auf die Überlebensfähigkeit von Viren haben können, kann man dann eigentlich die Mutationsrate im Labor bestimmen? Kann man auch letale (tödliche) Mutationen erfassen?
Steffen: Das ist tatsächlich nicht so einfach. Im Labor gibt es verschiedene Methoden, um Mutationsraten zu bestimmen. Das geht von der Bestimmung der reinen Aktivität der isolierten Polymerase und deren Fehlerrate hin zur Betrachtung gesamter Genome. Die meisten Methoden sind allerdings voreingenommen gegenüber funktionalen Mutationen, die dann auch mit einer bestimmten Häufigkeit auftreten. Man muss sich klar machen, dass Mutationen zufällig, zunächst als Einzelfall geschehen. Nur bestimmte Mutationen können sich in einer Viruspopulation, die immer aus verschiedenen Varianten besteht, manifestieren. Ja nach Methode gibt es Nachweisgrenzen für die Detektion einzelner Mutationen. Letale Mutationen sind häufig unterrepräsentiert in solchen Methoden. Man kann aber mathematisch hierfür korrigieren, wenn man die Mutationsrate berechnet. Allerdings ist dies nicht mein Fachgebiet. Mutationsraten unter Laborbedingungen zu bestimmen ist aber in jedem Fall nicht einfach, da hier einige Einflussfaktoren der Umwelt entfallen.
ZOOP: Welche anderen Faktoren bestimmen neben der Mutationsrate noch die genetische Diversität einer Population?
Steffen: Hier sind eine Reihe von Faktoren zu nennen. So spielt zum Beispiel die Größe der Population eine Rolle, die sowohl die Anzahl der Varianten innerhalb einer Population beeinflusst als auch die Wahrscheinlichkeit, dass sich eine Mutation durchsetzt. Auch der Wirt spielt eine große Rolle. Durch seine Immunantwort bestimmt er mit, welche Viren gut angepasst sind. Hier sind auch die Auswirkungen einer Co-Evolution nicht zu vernachlässigen. Zudem können Wirtswechsel eine Rolle spielen. Arboviren (Vektor-übertragene Viren) wechseln beispielsweise zwischen Säugetieren und Arthropoden, die sich sehr stark voneinander unterscheiden. Das hat einen Einfluss auf die Diversität. Zudem spielt der Selektionsdruck im Allgemeinen eine Rolle. So ist die Übertragung von Wirt zu Wirt immer ein Engpass für eine Viruspopulation, die meist nur durch wenige Varianten gemeistert wird, die dann wiederrum eine neue Viruspopulation begründen können.
ZOOP: Nicht jede Mutation verändert die Eigenschaften eines Virus. Welche Voraussetzungen müssen gegeben sein, damit eine Mutation veränderte Eigenschaften zur Folge hat?
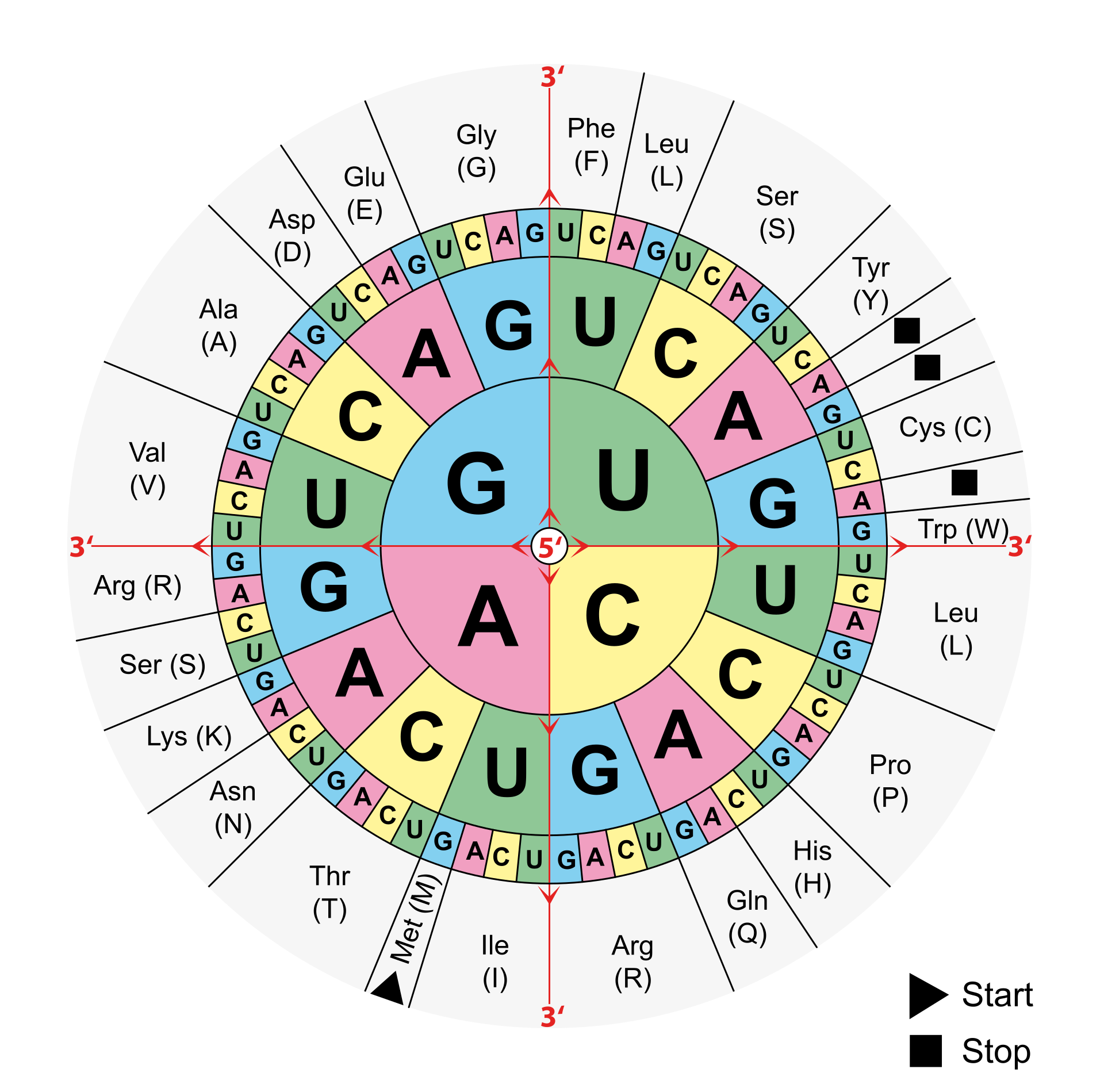
Steffen: Zum einen ist es wichtig zu wissen, dass je drei Nukleotide für eine Aminosäure kodieren. Diese drei Nukleotide, sogenannte Codons, sind allerdings redundant, d.h. es gibt mehrere Codons, die für die gleiche Aminosäure codieren. Nicht jede Veränderung auf Ebene der DNA oder RNA manifestiert sich also in einer veränderten Aminosäure im am Ende entstehenden Protein. Man spricht hier von stillen Mutationen. Andere Punktmutationen können wiederrum dazu führen, dass sogenannte STOPP-Codons entstehen, welche zu einem Abbruch des Ablesevorgangs führen können. Wenn es durch eine Mutation doch zu einem Aminosäureaustausch im Protein kommt, muss dieser nicht unbedingt Auswirkungen auf deren Funktion haben. Hier kommt es sehr stark darauf an, an welcher Stelle des Proteins der Austausch auftritt und welche Aminosäuren gegeneinander ausgetauscht werden.
Code-Sonne für den genetischen Code. Jeweils drei Nukleotide codieren eine Aminosäure aus denen am Ende ein Protein entsteht. Die Nukleinbasen werden von innen nach außen abgelesen, die jeweiligen Aminosäuren bzw. die Stopp-Signale sind am Rand ablesbar. (Bild: Mouagip)
„Das Virus-Genom ist auf das wesentliche reduziert“
ZOOP: Beim Menschen codieren nicht alle Genomabschnitte für Proteine. Wie verhält sich das bei Viren? Gibt es in deren Genom auch Abschnitte, die weniger relevant zu sein scheinen?
Steffen: Die Viren sind da effizienter. Ihr Genom ist auf das wesentliche reduziert. Deshalb brauchen sie auch die Wirtszelle, um sich zu vermehren. Häufig nutzen sie Enzyme der Zellen, welche sie nicht selber in ihrem eigenen Genom codieren. Einige Genome codieren nur für 4 oder 5 Proteine, die jedoch ausreichen, um den Vermehrungsvorgang zu realisieren. Es gibt bei den Viren verschiedene Mechanismen, um innerhalb dieser begrenzten Genomgröße möglichst viel zu codieren. Das virale Genom ist also wirklich sehr kompakt und das liegt eben auch daran, dass die Genomgröße durch die Mutationsrate begrenzt ist. In einem großen Genom könnten sich zu viele nachteilige Mutationen anhäufen. Im Labor merkt man dies, wenn man zum Beispiel versucht, bestimmte Sequenzen einzufügen (z.B. einen Farbstoff). Viele Viren haben die Tendenz diese Sequenzen schnell wieder aus ihrem Genom zu eliminieren, da sie keinen direkten Vorteil dadurch haben.
ZOOP: Betrachtet man die Interaktion zwischen Mutationen und Umwelt, kann man pauschal schlussfolgern, dass hohe Mutationsraten eher in einem dynamischen Umfeld hilfreich sind, während sie unter stabilen Umweltbedingungen eher nicht favorisiert werden?
Steffen: Zunächst einmal sind die Mutationsraten unabhängig von der Umwelt. Die Substitutionsrate (Rate, mit der sich Mutationen in einer Population manifestieren) wird hingegen von Umwelteinflüssen mitbestimmt. Bei Arboviren führen die durch den Wirtswechsel auftretenden Umweltveränderungen eher zu stabilen Populationen, da sich durch jeden Wirtswechsel die Diversität einer Population wieder reduziert. Wenn sich ein Virus frei ohne Einwirkungen eines Immunsystem vermehren kann, können zufällige Mutationen auftreten, die sich ggf. in einer Population festigen. Wenn nun ein Immunsystem ins Spiel kommt, wird man beobachten, dass die Selektion von Mutationen in eine bestimmte Richtung verschoben wird. Es ist ein Zusammenspiel zwischen positiver und negativer Selektion, welches durchaus auch durch die Umwelt beeinflusst werden kann. Die Mutationsrate selber bleibt gleich, weil sie von anderen Faktoren bestimmt wird.
„Mutationen, die zu einer höheren Fitness führen, sind grundsätzlich von Vorteil“
ZOOP: Was entscheidet darüber, ob sich eine Mutante in einer Population durchsetzen kann? Gewinnt die beste Anpassung?
Steffen: Zum einen spielt hierbei die Fitness eine Rolle, welche die Geschwindigkeit der Vermehrung beschreibt. Mutationen, die zu einer höheren Fitness führen, sind grundsätzlich von Vorteil. Zudem spielt die Robustheit von Mutationen eine Rolle. So werden beispielsweise Codons, die weiter entfernt von einem STOPP-Codon sind, präferiert, damit eine einzelne Punktmutation nicht gleich zum Abbruch der Proteinsequenz führen kann. In Bezug auf den Wirt werden beispielsweise Mutationen präferiert, die einen Vorteil im Hinblick auf das Immunsystem bringen, wie es auszuschalten oder die Erkennung durch Antikörper oder durch andere Immunzellen zu verhindern. Das führt dazu, dass sich die Viren besser vermehren können und sie nicht so schnell vom Immunsystem ausgelöscht werden können. Aber es gibt auch andere Mutationen, die dem Virus einen Vorteil bieten können, zum Beispiel beim Eintrittsvorgang in die Zelle über eine verbesserte Rezeptorbindung oder bei der Fähigkeit verschiedene Gewebe infizieren zu können (Gewebetropismus). Auch die Übertragung von Wirt zu Wirt spielt eine Rolle. Viren, bei denen die Übertragung gut funktioniert, haben natürlich einen Vorteil.
ZOOP: Sie haben eben bereits das Zusammenspiel zwischen Virus und Immunsystem des Wirtes angesprochen. Im Rahmen der SARS-CoV-2 Pandemie ist in den Medien oft das Wort „Escape Mutante“ zu lesen. Können Sie uns erklären was damit gemeint ist?
Steffen: Das beschreibt eine Mutation, die es dem Virus erlaubt nicht vom Immunsystem gesehen zu werden. Das Immunsystem besteht aus vielen verschiedenen Faktoren. Es gibt Antikörper, Immunzellen, und verschiedene andere Moleküle der angeborenen Immunität in Zellen, die alle erstmal dazu dienen eine Virusinfektion wahrzunehmen und dem Körper über Signalwege mitzuteilen, dass eine Virusinfektion vorliegt. Das Immunsystem wird alarmiert, um gegen die Infektion vorzugehen. Antikörper erkennen bestimmte Regionen an Proteinen, sogenannte Epitope. Wenn eine Mutation in der Region des Epitops auftritt, welche die Struktur des Proteins so verändert, dass Antikörper eines bestimmten Typs nicht mehr daran binden können, dann sprechen wir von einer „Escape Mutation“. Natürlich ist es aber immer noch möglich, dass sie von Antikörpern, die an andere Regionen des Proteins binden, erkannt wird.
„Es ist im Prinzip ein Tauziehen zwischen Wirt und Virus“
ZOOP: Sie haben bereits erwähnt, dass es zu einer Co-evolution von Virus und Wirt kommen kann. Was bedeutet eine Co-Evolution in diesem Fall?
Steffen: Eine Co-Evolution kommt zustande, wenn Viren nicht nur kurze, akute Infektionen, sondern auch längerfristige Infektionen verursachen und sich an den Wirt anpassen. Unter dem Druck des Immunsystems des Wirtes können sich Viren zum Beispiel so verändern, dass sie nicht mehr so stark durch das Immunsystem wahrgenommen werden. Das sieht man unter anderem bei Hepatitisviren. Hier kann die akute Infektion bereits viele Jahre zurückliegen, bevor die Krankheit erkannt wird. Das liegt daran, das die Viren lange Zeit unerkannt im Körper existieren können. Ein Phänomen was wir auch bei Viren sehen, die weniger starke Erkrankungen hervorrufen. Herpesviren sind hier ein Beispiel. Bei diesen Viren kann man bestimmte Anpassungen an den Wirt beobachten. Teils entwickeln sie Mechanismen, um mit dem Immunsystem des Wirtes zu interagieren, bestimmte Teile herunterregeln oder nachahmen. Es ist im Prinzip ein Tauziehen zwischen Wirt und Virus. Der Wirt möchte das Virus schnell eliminieren, während es eher im Interesse des Virus ist, langfristig im Wirt zu sein, statt eine schwere oder tödliche Infektion hervorzurufen.
„Viele sehr gefährliche Viren fallen in die Klasse der zoonotischen Viren“
ZOOP: Das Virus hat es also nicht zum Ziel uns umzubringen. Das ist erstmal beruhigend. Wie kommt es, dass es trotzdem tödliche Viren gibt?
Steffen: Das liegt vor allem daran, dass es nicht der richtige Wirt ist. Wir beobachten das insbesondere bei den zoonotischen Viren, die vom Tier auf den Menschen übertragen werden. Hier ist der Mensch nicht der geeignete Wirt für das Virus und es ist eher eine Nebenwirkung, dass der Mensch krank wird oder eventuell auch verstirbt. Im Interesse des Virus ist es eigentlich nicht. Bei diesen Viren gibt es sogenannte Reservoirwirte in denen die Viruspopulation langfristig vorliegt. Die Reservoirwirte unterhalten die Viruspopulation und zeigen meist keine Krankheitssymptome, obwohl sie große Kopiezahlen des Virus in sich tragen können. Das liegt daran das hier die Co-Evolution schon so weit fortgeschritten ist, dass Virus und Wirt relativ gut aneinander angepasst sind. Das Virus kann keinen großen Schaden mehr anrichten und der Wirt toleriert das Virus weitestgehend, so dass das Virus sich vermehren kann. Bei einem weniger geeigneten Wirt ist es meistens das Immunsystem, welches alarmiert wird und zu einer Erkrankung und schwerwiegenden Verläufen führt. Oftmals können die Viren das Immunsystem des neuen Wirtes nicht gut kontrollieren, dadurch kommt es manchmal auch zu einer zu starken Immunantwort, die gefährlich werden kann.
ZOOP: Was zoonotische Viren besonders gefährlich machen kann für den Mensch.
Steffen: Ja, viele sehr gefährliche Viren fallen in die Klasse der zoonotischen Viren.
ZOOP: Sie haben bereits erwähnt, dass das Genom von Viren auf das wesentliche reduziert ist. Dennoch spricht man auch hier von variablen und konservierten Regionen. Können Sie uns erklären was damit gemeint ist?
Steffen: Es bezieht sich darauf, dass sich nicht alle Mutationen innerhalb einer Population durchsetzen können. Mutationen entstehen zufällig an zufälligen Positionen im Genom. Aber es gibt bestimmte Regionen, wo Mutationen besser toleriert werden, wo es dem Virus unter Umständen sogar einen Vorteil verschafft, durch besser Fitness oder Rezeptorbindung oder ähnliches. Auf die Substitutionsrate bezogen findet man in diesen variablen Regionen Mutationen häufiger. In anderen Regionen im Genom werden Mutationen nicht so gut toleriert, wie beispielsweise Regionen, die für Enzyme codieren, die eine bestimmte Funktion haben. Treten hier Mutationen auf, kann die Funktion des Enzyms beeinträchtigt werden. In diesen konservierten Genomabschnitten finden sich daher weniger Mutationen, nicht weil sie dort nicht entstehen, sondern, weil sie sich in der Population nicht festigen können. Hier spielt also der Selektionsdruck eine Rolle.
„Bei SARS-CoV-2 finden sich bereits große Virusmengen in den oberen Atemwegen und dadurch ist die Übertragung einfacher“
ZOOP: Jetzt wo wir bereits einiges über Virusmutationen gelernt haben, möchte ich am Ende des Gespräches noch einmal auf SARS-CoV-2 zu sprechen kommen. Wenn man einen Vergleich zwischen SARS-CoV-2 und SARS-CoV-1 anstrebt, welche Veränderungen haben dazu geführt, dass das eine Virus eine Pandemie auslösen konnte und das andere nicht?
Steffen: Die größte Aufmerksamkeit gilt hier dem Oberflächenprotein, dem Spike-Protein. Hier gibt es eine Schnittstelle für Proteasen, die in SARS-CoV-2 vorliegt, die sogenannte Furin-Schnittstelle. Diese ist bereits von anderen Viren bekannt. Diese Oberflächenproteine müssen aktiviert werden, um den Zelleintritt vermitteln zu können. Hier haben verschiedene Viren verschiedene Strategien entwickelt. Für Coronaviren spielt die Spaltung durch Proteasen eine Rolle. Die neue Schnittstelle in SARS-CoV-2 führt zu einer höheren Aktivierung der Oberflächenproteine, in verschiedenen Zellen, u.a. in Lungenzellen.
Zudem ist die Übertragung anders, was daran liegt das SARS-CoV-2 auch in den oberen Atemwegen gefunden wird. Bei SARS-CoV-1 lag die höchste Virusmenge in der Lunge vor, die zu schweren Lungenentzündungen führte und damit zu der höheren Zahl an Toten gemessen an den Infektionen. Allerdings war das Virus dadurch schlechter übertragbar, weil das Virus erst tief aus der Lunge hochgehustet werden musste. Bei SARS-CoV-2 finden sich bereits große Virusmengen in den oberen Atemwegen und dadurch ist die Übertragung einfacher. Das alleine war schon ausreichend, um eine Pandemie auszulösen.
„Es war zu erwarten, dass es Veränderungen geben würde“
ZOOP: SARS-CoV-2 ist also zumindest nicht tödlicher, aber leichter übertragbar als SARS-CoV-1. Mittlerweile sind bereits einige Mutanten von SARS-CoV-2 im Umlauf, die für einiges Unbehagen sorgen. Überrascht es sie, das so viele relevante Mutanten aufgetreten sind oder war das in ihren Augen erwartbar bei einem RNA-Virus?
Steffen: Ich denke, das war zu erwarten. Die Populationsgröße, die eine Rolle spielt, ist natürlich bei einer weltweiten Zirkulation des Virus gegeben. Es war also zu erwarten, dass es Veränderungen geben würde, die sich in Populationen durchsetzen werden, weil sie Vorteile bringen. Aber natürlich ist es auch besorgniserregend. Auch wenn wir davon ausgehen, dass sich das Virus ein wenig dem Wirt anpassen wird, werden sich möglicherweise auch Escape Mutationen in der Population festigen können, die es dem Virus ermöglichen, dem Immunsystem des Menschen zu entkommen. Also erwartet ja aber auch beunruhigend. Ich denke also es ist richtig und wichtig, dass dies jetzt genauer beobachtet und bewertet wird.
„wir haben bereits eine relativ gute Infrastruktur in Deutschland, aber die muss nun gezielt ausgebaut und gefördert werden“
ZOOP: Glauben Sie das Deutschland in diesem Zusammenhang mehr für die molekulare Surveillance tun sollte?
Steffen: Ich denke, da müsste mehr passieren. Im internationalen Vergleich stand Deutschland da noch nie besonders gut dar. Aber das Ganze hat natürlich auch finanzielle Grenzen und man muss schauen, was hier investiert werden kann. Ich glaube schon, dass es ein Bereich ist, in den man investieren sollte und muss. Ich denke es ist dringend nötig. In der Zukunft stelle ich mir vor, dass die Bestimmung kompletter Genomsequenzen zur Standarddiagnostik wird und daraufhin Patienten auch individueller therapiert werden können. Bis dahin ist es sicherlich noch ein weiter Weg, aber ich denke die Pandemie ist ein guter Anstoß für Deutschland hier Kapazitäten auszubauen.
ZOOP: Vielleicht kann man in diesem Bereich auch auf technische Fortschritte hoffen, welche die Sequenzierung in der Zukunft einfacher und kostengünstiger werden lassen.
Steffen: Ja, davon gehe ich aus. In diesem Bereich gibt es große Fortschritte. Aber noch sind wir einen Schritt weit davon entfernt. Daher müssen wir zunächst mit dem arbeiten, was wir haben. Ich denke wir haben bereits eine relativ gute Infrastruktur in Deutschland, aber die muss nun gezielt ausgebaut und gefördert werden.
„Mutationen können immer in beide Richtungen gehen und müssen nicht immer unbedingt negative Auswirkungen haben“
ZOOP: Als Abschlussfrage noch einmal eine Frage zu Mutationen allgemein. In der Öffentlichkeit ist der Begriff „Mutation“ oft negativ besetzt. Woran glauben Sie liegt das? Schließlich ist es ja ein ganz alltäglicher Vorgang.
Steffen: Ich glaube es liegt daran, dass wir über Mutationen meist im Zusammenhang mit Erkrankungen sprechen. Jetzt mit den Viren sprechen wir davon, dass Mutationen das Virus gefährlicher machen und auch im Bezug auf Krebs wird von Mutationen gesprochen, die vererbbare Genveränderungen und -defekte zur Folge haben. Dadurch entsteht vermutlich der Unterton, dass Mutationen etwas Negatives sind. Aber natürlich sollte man hier auch im Hinterkopf behalten, dass Mutationen auch dazu führen können, dass ein Virus weniger gefährlich wird, dass es sich besser an den Wirt anpasst oder leichter abgewehrt werden kann. Mutationen können immer in beide Richtungen gehen und müssen nicht immer unbedingt negative Auswirkungen haben.
ZOOP: Ein schönes Schlusswort für das Gespräch: „Mutationen sind nicht immer negativ“. Frau Dr. Steffen, wir danken Ihnen herzlich für das Gespräch!
Interview: Dr. Dana Thal i. A. für die Nationale Forschungsplattform für Zoonosen